Aparte os gases ideais - uma idealização extremamente útil como primeiro passo no estudo e compreensão dos sistemas físicos termodinâmicos - verifica-se que a estrutura da matéria conforme atualmente concebida implica relações ora mais ora menos vigorosas entre as partículas fundamentais que a integram. Particularmente importante no estado sólido, e gradualmente menos significativa nos líquidos e nos gases reais, em escala atômica as relações entre as partículas em questão - os átomos - são sobretudo as determinadas por interações de natureza elétrica. Quer ionizados quer não, em sólidos os átomos assumem posições relativas tais que, caso esses tentem se afastar demasiadamente, os efeitos elétricos oriundos da interação das nuvens eletrônicas entre si e com os respectivos núcleos atômicos estabelecem forças que novamente os aproximam. Contudo a aproximação em demasia também implica forças de natureza elétrica, agora repulsivas. O balanço entre as duas situações estabelece configurações espaciais de equilíbrio, sendo responsável, entre outros, pelas estruturas das ligações covalentes bem como da amostra como um todo em compostos moleculares; pelas disposições dos íons bem como pelo parâmetros de rede em estruturas iônicas cristalinas; e pelas características dos materiais com ligações metálicas.
O comportamento de tais interações é descrito via considerações acerca das energias potenciais elétricas - no contexto nomeada energia química - envolvidas. Embora as energias potenciais sejam usualmente dependente das separações atômicas de maneira não muito trivial, os cálculos demonstram que, para pequenos deslocamentos em torno das posições de equilíbrio, tal dependência pode ser muito bem descrita via uma aproximação quadrática. Tal potencial energético implica diretamente, como resposta às equações dinâmicas, movimentos harmônicos em torno dos pontos de equilíbrio para as partículas em questão; em tudo similares aos movimentos descritos por objetos maciços quando atrelados a molas e sujeitos à lei de Hooke. A aproximação torna-se gradualmente menos precisa para os líquidos e talvez inadequada os gases reais em virtude do gradual aumento nas amplitudes de movimento das partículas em torno dos assumidos existentes pontos de equilíbrio, contudo para sólidos e líquidos o princípio permanece essencialmente válido. Sendo característico do comportamento elástico, a aproximação de potencial parabólico em torno dos pontos de equilíbrio permite por comparação modelar a matéria como um conjunto de partículas puntuais inter-acopladas por molas; e em tal modelo é fácil compreender-se a natureza da transmissão de energia térmica por condução.
A condução é feita devido às moléculas de maior energia cinética, oscilando com maiores amplitudes em torno dos pontos de equilíbrio, transmitirem energia através dos acoplamentos elásticos para as partículas vizinhas menos energéticas. Lembrando-se do conceito de temperatura como grandeza proporcional à energia cinética média das partícula do sistema, percebe-se claramente a diferença de temperaturas como sendo o fator causal do calor por condução.
A condução é, conforme esperado, geralmente muito significativa em sólidos e líquidos, mas certamente também ocorre, contudo de forma menos importante, em gases. Considerado que os gases reais não são a rigor gases ideias, sabe-se que há interação entre as partículas que o compõem, de forma que o modelo anterior não mostra-se de todo errado. Contudo, mesmos no caso dos gases ideais - onde não verifica-se, por definição, qualquer acoplamento entre as partículas que o definem - pode-se ainda conceber a existência de condução térmica, visto que essas partículas ainda interagem, contudo apenas com as paredes do recipiente que as encerram. Se duas paredes em extremidades opostas do recipiente contendo um gás ideal forem mantidas à temperaturas diferentes, verificar-se-á fluxo de calor por condução entre as mesmas visto que as partículas gasosas, embora possam mover-se livremente no interior do recipiente, encontrando-se contudo por esse confinadas, e por tal colidindo ora com uma, ora com a outra parede do recipiente.
Quantitativamente, a taxa ou fluxo de calor - também nomeada corrente térmica (corrente de calor[Ref. 4]) é usualmente medido em joules por segundo (watts), ou de forma alternativa em calorias por segundo - que ocorre em uma barra cilíndrica ou prismática cujas extremidades estejam conectadas a reservatórios térmicos a diferentes temperaturas, e cuja extensão longitudinal encontre-se envolta por isolante térmico, quando em regime estacionário, é função das dimensões da barra, do material do qual é feita, e da diferença de temperaturas entre as fontes quente e fria às quais essa encontra-se conectada. Empiricamente determina-se, o que ficou conhecido como Lei do resfriamento de Newton[Ref. 5], que:
com
- .
Nas expressões acima têm-se:
- área da seção reta perpendicular ao fluxo de calor;
- intervalo de tempo considerado;
- diferença de temperaturas entre os extremos da barra;
- quantidade de calor que flui através da seção no intervalo considerado;
- comprimento da barra (X na figura);
- condutividade térmica, constante que caracteriza o material do qual a barra é feito.
Apresenta-se também uma tabela com as condutividades térmicas para alguns materiais de uso frequente.
| Substância | Substância | ||||
|---|---|---|---|---|---|
| Prata | 406 | 0,097 | Hidrogênio | 0,14 | 33 x 10 -6 |
| Cobre | 385 | 0,092 | Gelo a 0oC | 2,2 | 0,53 x 10 -3 |
| ouro | 317 | 0,076 | Amianto | 0,09 | 22 x 10 -6 |
| alumínio | 205 | 0,049 | Vidro | [0,6 - 0,8] | [0,14 - 0,19] x 10 -3 |
| chumbo | 34,7 | 8,3 x 10 -3 | Concreto | 0,8 | 0,19 x 10 -3 |
| Titânio | 21,9 | 5,2 x 10 -3 | Baquelite | 1,4 | 0,33 x 10 -3 |
| Ferro | 80,2 | 0,019 | Madeira | [0,04 - 0,26] | [9,6 - 62]x 10 -6 |
| Aço carbono | 50 | 0,012 | Cortiça | 0,04 | 9,6 x 10 -6 |
| Aço inox | 14 | 3,3 x 10 -3 | Aerogel | 0,003 | 0,7 x 10 -6 |
| ar | 0,024 | 5,7 x 10 -6 | Mylar | 0,0001 | 0,02 x 10 -6 |
Os princípios físicos envolvidos no problema acima constituem o ponto de partida para a solução de qualquer problema relativo ao calor por condução. Como mero exemplo de seu uso, considerando-se ainda a situação em regime estacionário, o fundamento matemático atrelado pode ser estendido a cilindros ou prismas não isotrópicos ao longo das seções retas, para tal bastando transpor-se a área A para o outro lado da equação a fim de definir-se uma nova grandeza, denominada densidade de corrente térmica tal que:
Tal definição, em termos diferenciais, implica:
com
Na expressão acima, representa a densidade de corrente de calor em um diferencial de área dA situado em um ponto específico (x,y,z) do volume, ponto esse caracterizado por uma condutividade térmica constante ao longo do eixo x (o eixo axial). Os termos dQ, dA, dT bem como dt são os respectivos diferenciais atrelados às grandezas anteriormente definidas, determinados em cada ponto do volume em consideração.
A diferença entre e reside basicamente no fato de que representa, no caso geral, o valor médio de sobre a seção reta total A do prisma ou cilindro especificado:
No caso da barra isotrópica antes considerado, sendo o material essencialmente o mesmo em todos os pontos, iguala-se a em qualquer ponto.
A integração é fácil quando tem-se (dT/dX) = (dT/dL) constante e por tal facilmente conhecido - o que ocorre quando há simetria longitudinal de fluxo de calor, conforme considerado - contudo pode implicar problemas bem mais sofisticados - exigindo considerações vetoriais e a aplicação de conceitos como solução por séries de Fourier bem como técnicas específicas, a exemplo as aplicadas nos problemas com condições de contorno não adiabáticas de Neumann ou Dirichilet - nos casos onde não há tal simetria e a próprio gradiente de temperatura (dT/dX no caso considerado) é também uma grandeza a ser determinada, como função não apenas de cada ponto do objeto em consideração mas também como função do tempo. Buscam-se nesses casos as determinações não apenas dos estados estacionários condizentes com as condições de contorno fornecidas como também a evolução do sistema no tempo; incluso o comportamento transitório, a partir do estado inicial também fornecido. Tais problemas são usualmente complicados o suficiente para demandarem artigo específico e, por vezes, seções inteiras de livros sobre equações diferenciais [Ref. 5]. As presenças de fontes térmicas também devem ser consideradas, e estas geralmente complicam ainda mais os problemas; que matematicamente consistem em se buscar as soluções adequadas para a equação diferencial parcial conhecida como Equação da Condução de Calor:
Na equação acima, corresponde ao campo de temperaturas como função do tempo e das coordenadas espaciais procurado; e informa acerca das fontes térmicas presentes no sistema sob análise; o "nabla quadrado" () representa o operador Laplaciano - em essência derivadas parciais de segunda ordem em relação a cada uma das coordenadas espaciais; e é o coeficiente de difusão térmica, constante intimamente relacionada à condutividade térmica k.
A equação de condução do calor é matematicamente obtida a partir dos princípios físicos básicos encerados na Lei do resfriamento de Newton[Ref. 5].
O estudo do calor por condução mostra-se relevante em eletrônica em virtude da integração dos circuitos eletrônicos. Os dissipadores de energia térmica, popularmente conhecidos como dissipadores de calor, funcionam essencialmente via calor por condução. A condução térmica tem grande aplicação também no estudo e projeto das máquinas térmicas, a exemplo nos projetos dos motores a combustão interna, bem como nos projetos de dispositivos refrigeradores, como geladeiras e ares-condicionados.
Convecção[editar | editar código-fonte]
A convecção já não é a nível molecular como era o caso da condução. Esta já pode ser de duas formas, por convecção natural em que é devido à diferença de densidade do fluido devido ao aquecimento do fluido ou por convecção forçada em que existe um mecanismo externo ao sistema a forçar o movimento do fluido. Este mecanismo é segundo a Lei de Newton. q=h(T_s-T_∞) Em que: qx é a taxa de transferência de calor por unidade de área perpendicular à superfície em [W/m2]. h é o coeficiente de transferência de calor que depende das condições e natureza do escoamento, da geometria da superfície e das propriedades do fluido em [W/m2*K].
Radiação[editar | editar código-fonte]
Qualquer corpo ou superfície a uma temperatura superior ao zero absoluto emite radiação electromagnética por alteração na configuração electrónica de átomos e moléculas. A radiação térmica está restrita aos comprimentos de onda entre 0.1 e 100 μm do espectro electromagnético. A propagação de ondas electromagnéticas (ou fotões) ocorre através de corpos ou fluidos não opacos, ou no vácuo, não precisando, portanto, da existência de matéria. A lei básica é a lei de Stefan-Boltzmann. Como se pode concluir, o transporte de energia associado a este mecanismo é qualitativamente diferente dos mecanismos referidos acima (condução e convecção). Contudo, uma vez que todas as superfícies emitem radiação térmica, e esta será tanto maior quanto mais elevada for a temperatura, se um corpo emitir mais energia do que aquela que recebe proveniente das superfícies envolventes, a temperatura desse corpo diminuirá.
Tipos de calor[editar | editar código-fonte]
- Calor sensível: provoca apenas a variação da temperatura do corpo. A quantidade de calor sensível (Q) que um corpo de massa (m) recebe é diretamente proporcional à sua variação de temperatura (). Logo, é possível calcular a quantidade de calor sensível usando a seguinte fórmula:
- Calor latente: provoca algum tipo de alteração na estrutura física do corpo. É a quantidade de calor que a substância troca por grama de massa durante a mudança de estado físico. É representado pela letra L. É medido em caloria por grama (cal/g).
Para calcular o calor latente é necessário utilizar a seguinte expressão:
Onde Q é a quantidade de calor recebida ou cedida pelo corpo, m é a massa do corpo e L é o calor latente ou calor de transformação mássico (é a energia necessária fornecer á massa de 1 kg de substância para que mude de estado).
Calor específico (c)[editar | editar código-fonte]
Ao contrário da capacidade térmica, o calor específico não é característica do corpo, mas sim característica da substância. Corresponde à quantidade de calor recebida ou cedida por 1 g da substância que leva a uma variação de 14,5°C para 15,5°C na temperatura do corpo em questão. É dado pela relação da capacidade térmica do corpo pela sua massa. É representado pela letra c (minúscula) e é medido em cal/g.°C ou cal/g.K:
Quantidade de Calor [editar | editar código-fonte]
Grandeza física que determina a variação na quantidade de energia térmica em um corpo, ou seja, determina a energia térmica que transitou para outro corpo ou que mudou de natureza. A unidade do SI para quantidade de calor é o J (Joule), mas é comum usar cal (Caloria) ou Cal (Caloria lateral).
Fórmulas[editar | editar código-fonte]
A quantidade de calor pode ser representada por representando uma variação de energia térmica no corpo (perceba que a energia não se perde, apenas transita ou muda de natureza).
Quantidade de calor sensível[editar | editar código-fonte]
Essas são as fórmulas para se calcular a quantidade de calor que não causa mudança de estado físico, apenas de temperatura.
A quantidade de calor sensível () pode ser calculada a partir da potência de uma fonte térmica () e do tempo de fornecimento de energia a partir dessa fonte térmica ().
Também é possível calcular a quantidade de calor a partir da massa da substância que sofre variação térmica (), do calor específico dela () e da variação térmica que o corpo sofre ().
Quantidade de calor latente[editar | editar código-fonte]
É a quantidade de calor que causa mudança de estado físico, mas não de temperatura.
A quantidade de calor latente () pode ser calculada pelo calor latente () e pela massa da substância.
Aparte os gases ideais - uma idealização extremamente útil como primeiro passo no estudo e compreensão dos sistemas físicos termodinâmicos - verifica-se que a estrutura da matéria conforme atualmente concebida implica relações ora mais ora menos vigorosas entre as partículas fundamentais que a integram. Particularmente importante no estado sólido, e gradualmente menos significativa nos líquidos e nos gases reais, em escala atômica as relações entre as partículas em questão - os átomos - são sobretudo as determinadas por interações de natureza elétrica. Quer ionizados quer não, em sólidos os átomos assumem posições relativas tais que, caso esses tentem se afastar demasiadamente, os efeitos elétricos oriundos da interação das nuvens eletrônicas entre si e com os respectivos núcleos atômicos estabelecem forças que novamente os aproximam. Contudo a aproximação em demasia também implica forças de natureza elétrica, agora repulsivas. O balanço entre as duas situações estabelece configurações espaciais de equilíbrio, sendo responsável, entre outros, pelas estruturas das ligações covalentes bem como da amostra como um todo em compostos moleculares; pelas disposições dos íons bem como pelo parâmetros de rede em estruturas iônicas cristalinas; e pelas características dos materiais com ligações metálicas.
O comportamento de tais interações é descrito via considerações acerca das energias potenciais elétricas - no contexto nomeada energia química - envolvidas. Embora as energias potenciais sejam usualmente dependente das separações atômicas de maneira não muito trivial, os cálculos demonstram que, para pequenos deslocamentos em torno das posições de equilíbrio, tal dependência pode ser muito bem descrita via uma aproximação quadrática. Tal potencial energético implica diretamente, como resposta às equações dinâmicas, movimentos harmônicos em torno dos pontos de equilíbrio para as partículas em questão; em tudo similares aos movimentos descritos por objetos maciços quando atrelados a molas e sujeitos à lei de Hooke. A aproximação torna-se gradualmente menos precisa para os líquidos e talvez inadequada os gases reais em virtude do gradual aumento nas amplitudes de movimento das partículas em torno dos assumidos existentes pontos de equilíbrio, contudo para sólidos e líquidos o princípio permanece essencialmente válido. Sendo característico do comportamento elástico, a aproximação de potencial parabólico em torno dos pontos de equilíbrio permite por comparação modelar a matéria como um conjunto de partículas puntuais inter-acopladas por molas; e em tal modelo é fácil compreender-se a natureza da transmissão de energia térmica por condução.
A condução é feita devido às moléculas de maior energia cinética, oscilando com maiores amplitudes em torno dos pontos de equilíbrio, transmitirem energia através dos acoplamentos elásticos para as partículas vizinhas menos energéticas. Lembrando-se do conceito de temperatura como grandeza proporcional à energia cinética média das partícula do sistema, percebe-se claramente a diferença de temperaturas como sendo o fator causal do calor por condução.
A condução é, conforme esperado, geralmente muito significativa em sólidos e líquidos, mas certamente também ocorre, contudo de forma menos importante, em gases. Considerado que os gases reais não são a rigor gases ideias, sabe-se que há interação entre as partículas que o compõem, de forma que o modelo anterior não mostra-se de todo errado. Contudo, mesmos no caso dos gases ideais - onde não verifica-se, por definição, qualquer acoplamento entre as partículas que o definem - pode-se ainda conceber a existência de condução térmica, visto que essas partículas ainda interagem, contudo apenas com as paredes do recipiente que as encerram. Se duas paredes em extremidades opostas do recipiente contendo um gás ideal forem mantidas à temperaturas diferentes, verificar-se-á fluxo de calor por condução entre as mesmas visto que as partículas gasosas, embora possam mover-se livremente no interior do recipiente, encontrando-se contudo por esse confinadas, e por tal colidindo ora com uma, ora com a outra parede do recipiente.
Quantitativamente, a taxa ou fluxo de calor - também nomeada corrente térmica (corrente de calor[Ref. 4]) é usualmente medido em joules por segundo (watts), ou de forma alternativa em calorias por segundo - que ocorre em uma barra cilíndrica ou prismática cujas extremidades estejam conectadas a reservatórios térmicos a diferentes temperaturas, e cuja extensão longitudinal encontre-se envolta por isolante térmico, quando em regime estacionário, é função das dimensões da barra, do material do qual é feita, e da diferença de temperaturas entre as fontes quente e fria às quais essa encontra-se conectada. Empiricamente determina-se, o que ficou conhecido como Lei do resfriamento de Newton[Ref. 5], que:
- xΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
com
- .
- xΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
Nas expressões acima têm-se:
- área da seção reta perpendicular ao fluxo de calor;
- intervalo de tempo considerado;
- diferença de temperaturas entre os extremos da barra;
- quantidade de calor que flui através da seção no intervalo considerado;
- comprimento da barra (X na figura);
- condutividade térmica, constante que caracteriza o material do qual a barra é feito.
Apresenta-se também uma tabela com as condutividades térmicas para alguns materiais de uso frequente.
| Substância | Substância | ||||
|---|---|---|---|---|---|
| Prata | 406 | 0,097 | Hidrogênio | 0,14 | 33 x 10 -6 |
| Cobre | 385 | 0,092 | Gelo a 0oC | 2,2 | 0,53 x 10 -3 |
| ouro | 317 | 0,076 | Amianto | 0,09 | 22 x 10 -6 |
| alumínio | 205 | 0,049 | Vidro | [0,6 - 0,8] | [0,14 - 0,19] x 10 -3 |
| chumbo | 34,7 | 8,3 x 10 -3 | Concreto | 0,8 | 0,19 x 10 -3 |
| Titânio | 21,9 | 5,2 x 10 -3 | Baquelite | 1,4 | 0,33 x 10 -3 |
| Ferro | 80,2 | 0,019 | Madeira | [0,04 - 0,26] | [9,6 - 62]x 10 -6 |
| Aço carbono | 50 | 0,012 | Cortiça | 0,04 | 9,6 x 10 -6 |
| Aço inox | 14 | 3,3 x 10 -3 | Aerogel | 0,003 | 0,7 x 10 -6 |
| ar | 0,024 | 5,7 x 10 -6 | Mylar | 0,0001 | 0,02 x 10 -6 |
Os princípios físicos envolvidos no problema acima constituem o ponto de partida para a solução de qualquer problema relativo ao calor por condução. Como mero exemplo de seu uso, considerando-se ainda a situação em regime estacionário, o fundamento matemático atrelado pode ser estendido a cilindros ou prismas não isotrópicos ao longo das seções retas, para tal bastando transpor-se a área A para o outro lado da equação a fim de definir-se uma nova grandeza, denominada densidade de corrente térmica tal que:
-
- xΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
Tal definição, em termos diferenciais, implica:
com
Na expressão acima, representa a densidade de corrente de calor em um diferencial de área dA situado em um ponto específico (x,y,z) do volume, ponto esse caracterizado por uma condutividade térmica constante ao longo do eixo x (o eixo axial). Os termos dQ, dA, dT bem como dt são os respectivos diferenciais atrelados às grandezas anteriormente definidas, determinados em cada ponto do volume em consideração.
A diferença entre e reside basicamente no fato de que representa, no caso geral, o valor médio de sobre a seção reta total A do prisma ou cilindro especificado:
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
No caso da barra isotrópica antes considerado, sendo o material essencialmente o mesmo em todos os pontos, iguala-se a em qualquer ponto.
A integração é fácil quando tem-se (dT/dX) = (dT/dL) constante e por tal facilmente conhecido - o que ocorre quando há simetria longitudinal de fluxo de calor, conforme considerado - contudo pode implicar problemas bem mais sofisticados - exigindo considerações vetoriais e a aplicação de conceitos como solução por séries de Fourier bem como técnicas específicas, a exemplo as aplicadas nos problemas com condições de contorno não adiabáticas de Neumann ou Dirichilet - nos casos onde não há tal simetria e a próprio gradiente de temperatura (dT/dX no caso considerado) é também uma grandeza a ser determinada, como função não apenas de cada ponto do objeto em consideração mas também como função do tempo. Buscam-se nesses casos as determinações não apenas dos estados estacionários condizentes com as condições de contorno fornecidas como também a evolução do sistema no tempo; incluso o comportamento transitório, a partir do estado inicial também fornecido. Tais problemas são usualmente complicados o suficiente para demandarem artigo específico e, por vezes, seções inteiras de livros sobre equações diferenciais [Ref. 5]. As presenças de fontes térmicas também devem ser consideradas, e estas geralmente complicam ainda mais os problemas; que matematicamente consistem em se buscar as soluções adequadas para a equação diferencial parcial conhecida como Equação da Condução de Calor:
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Na equação acima, corresponde ao campo de temperaturas como função do tempo e das coordenadas espaciais procurado; e informa acerca das fontes térmicas presentes no sistema sob análise; o "nabla quadrado" () representa o operador Laplaciano - em essência derivadas parciais de segunda ordem em relação a cada uma das coordenadas espaciais; e é o coeficiente de difusão térmica, constante intimamente relacionada à condutividade térmica k.
A equação de condução do calor é matematicamente obtida a partir dos princípios físicos básicos encerados na Lei do resfriamento de Newton[Ref. 5].
O estudo do calor por condução mostra-se relevante em eletrônica em virtude da integração dos circuitos eletrônicos. Os dissipadores de energia térmica, popularmente conhecidos como dissipadores de calor, funcionam essencialmente via calor por condução. A condução térmica tem grande aplicação também no estudo e projeto das máquinas térmicas, a exemplo nos projetos dos motores a combustão interna, bem como nos projetos de dispositivos refrigeradores, como geladeiras e ares-condicionados.
Convecção[editar | editar código-fonte]
A convecção já não é a nível molecular como era o caso da condução. Esta já pode ser de duas formas, por convecção natural em que é devido à diferença de densidade do fluido devido ao aquecimento do fluido ou por convecção forçada em que existe um mecanismo externo ao sistema a forçar o movimento do fluido. Este mecanismo é segundo a Lei de Newton. q=h(T_s-T_∞) Em que: qx é a taxa de transferência de calor por unidade de área perpendicular à superfície em [W/m2]. h é o coeficiente de transferência de calor que depende das condições e natureza do escoamento, da geometria da superfície e das propriedades do fluido em [W/m2*K].
Radiação[editar | editar código-fonte]
Qualquer corpo ou superfície a uma temperatura superior ao zero absoluto emite radiação electromagnética por alteração na configuração electrónica de átomos e moléculas. A radiação térmica está restrita aos comprimentos de onda entre 0.1 e 100 μm do espectro electromagnético. A propagação de ondas electromagnéticas (ou fotões) ocorre através de corpos ou fluidos não opacos, ou no vácuo, não precisando, portanto, da existência de matéria. A lei básica é a lei de Stefan-Boltzmann. Como se pode concluir, o transporte de energia associado a este mecanismo é qualitativamente diferente dos mecanismos referidos acima (condução e convecção). Contudo, uma vez que todas as superfícies emitem radiação térmica, e esta será tanto maior quanto mais elevada for a temperatura, se um corpo emitir mais energia do que aquela que recebe proveniente das superfícies envolventes, a temperatura desse corpo diminuirá.
Tipos de calor[editar | editar código-fonte]
- Calor sensível: provoca apenas a variação da temperatura do corpo. A quantidade de calor sensível (Q) que um corpo de massa (m) recebe é diretamente proporcional à sua variação de temperatura (). Logo, é possível calcular a quantidade de calor sensível usando a seguinte fórmula:
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
- Calor latente: provoca algum tipo de alteração na estrutura física do corpo. É a quantidade de calor que a substância troca por grama de massa durante a mudança de estado físico. É representado pela letra L. É medido em caloria por grama (cal/g).
Para calcular o calor latente é necessário utilizar a seguinte expressão:
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Onde Q é a quantidade de calor recebida ou cedida pelo corpo, m é a massa do corpo e L é o calor latente ou calor de transformação mássico (é a energia necessária fornecer á massa de 1 kg de substância para que mude de estado).
Calor específico (c)[editar | editar código-fonte]
Ao contrário da capacidade térmica, o calor específico não é característica do corpo, mas sim característica da substância. Corresponde à quantidade de calor recebida ou cedida por 1 g da substância que leva a uma variação de 14,5°C para 15,5°C na temperatura do corpo em questão. É dado pela relação da capacidade térmica do corpo pela sua massa. É representado pela letra c (minúscula) e é medido em cal/g.°C ou cal/g.K:
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Quantidade de Calor [editar | editar código-fonte]
Grandeza física que determina a variação na quantidade de energia térmica em um corpo, ou seja, determina a energia térmica que transitou para outro corpo ou que mudou de natureza. A unidade do SI para quantidade de calor é o J (Joule), mas é comum usar cal (Caloria) ou Cal (Caloria lateral).
Fórmulas[editar | editar código-fonte]
A quantidade de calor pode ser representada por representando uma variação de energia térmica no corpo (perceba que a energia não se perde, apenas transita ou muda de natureza).
Quantidade de calor sensível[editar | editar código-fonte]
Essas são as fórmulas para se calcular a quantidade de calor que não causa mudança de estado físico, apenas de temperatura.
A quantidade de calor sensível () pode ser calculada a partir da potência de uma fonte térmica () e do tempo de fornecimento de energia a partir dessa fonte térmica ().
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Também é possível calcular a quantidade de calor a partir da massa da substância que sofre variação térmica (), do calor específico dela () e da variação térmica que o corpo sofre ().
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Quantidade de calor latente[editar | editar código-fonte]
É a quantidade de calor que causa mudança de estado físico, mas não de temperatura.
A quantidade de calor latente () pode ser calculada pelo calor latente () e pela massa da substância.
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
,
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
onde a nova função de estado é entalpia do sistema.
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Calor específico é uma grandeza física intensiva que define a variação térmica de determinada substância ao receber determinada quantidade de calor. Também é chamado de capacidade térmica mássica. A unidade no SI é (joule por quilograma e por kelvin). Uma unidade usual bastante utilizada para calores específicos é cal/(g.°C) (caloriapor grama e por grau Celsius).[1]
Em rigor há dois calores específicos distintos: o calor específico a volume constante e o calor específico a pressão constante . O calor específico a pressão constante é geralmente um pouco maior do que o calor específico a volume constante, sendo a afirmação verdadeira para materiais com coeficientes de dilatação volumétrico positivos. Em virtude do aumento de volume associado à dilatação térmica, parte da energia fornecida na forma de calor é usada para realizar trabalho contra o ambiente a pressão constante e não para aumentar a temperatura em si; o aumento de temperatura experimentado para um sistema à pressão constante é pois menor do que aquele que seria experimentado pelo mesmo sistema imposto o volume constante uma vez mantida a mesma transferência de energia na forma de calor. No caso do calor específico a volume constante, toda a energia recebida na forma de calor é utilizada para elevar a temperatura do sistema, o que faz com que — em virtude de sua definição — seja um pouco menor. A diferença entre os dois é particularmente importante em gases; em sólidos e líquidos sujeitos a pequenas variações de volume frente às variações de temperatura, os valores dos dois na maioria das vezes se confundem por aproximação. Em análise teórica e de precisão, contudo, é importante a diferenciação dos dois.
Materiais com dilatação anômala, como a água entre 0 °C e 4 °C, não obedecem à regra anterior; nestes casos o calor específico a volume constante é então um pouco maior do que o calor específico a pressão constante.
O calor específico () de uma substância pode ser definido a partir da capacidade térmica () de um corpo composto por ela como o quociente desta pela massa () desse corpo.[2] Matematicamente,
A capacidade térmica, por sua vez, é definida como a razão entre calor recebido e variação de temperatura observada. Assim, o calor específico pode ser expresso como:
Por essa última relação, nota-se que o calor específico depende do processo pelo qual o calor é cedido à substância. Usando a primeira lei da termodinâmica, com sendo a pressão, pode-se escrever:
Dois casos particulares são de maior importância. Um deles é o calor específico a volume constante, onde o termo representando o trabalho () é nulo, e pela relação anterior
O segundo caso é o calor específico a pressão constante. Nesse caso, a equação anterior resulta em
,
A distinção entre esses dois calores específicos pode normalmente ser ignorada nas fases sólida e líquida, dado que essas substâncias normalmente sofrem uma variação de volume muito pequena. Gases, no entanto, apresentam grande expansão térmica, sendo sempre necessária a distinção entre ambos os calores específicos.
Calor específico molar[editar | editar código-fonte]
Em muitas circunstâncias a unidade mais conveniente para especificar a quantidade de uma substancia é o mol, definido como sendo uma quantidade de 6,02 x 1023 unidades elementares de qualquer substância. Assim, por exemplo um mol de alumínio significa 6,02 x 1023 átomos de alumínio (o átomo é a unidade elementar), e 1 mol de óxido de alumínio significa 6,02 x 1023 fórmulas moleculares do composto.
Nesses casos, quando a quantidade de substância é expressa em moles, utiliza-se o chamado calor específico molar, que é expresso como sendo a capacidade térmica por mol.[4] De forma análoga com o calor específico por massa, o calor específico molar depende do processo ao qual a substância é submetida; define-se de mesma forma as quantidades a pressão constante e a volume constante.
Calor específico molar a volume constante[editar | editar código-fonte]
O calor específico molar a volume constante é definido como:
Sendo que,
(primeira lei da termodinâmica) com o trabalho temos ,por se tratar de um processo a volume constante.
onde:
- é o calor absorvido ou cedido por uma amostra de moles de um gás;
- é a variação de temperatura resultante;
- é a variação de energia interna.
Para um gás monoatômico ideal,
Calor específico molar a pressão constante[editar | editar código-fonte]
O calor específico molar a pressão constante é definido como:
Sendo que temos as seguintes relações:
(primeira lei da termodinâmica) e . Relacionando o trabalho com a equação dos gases ideais ficamos com . Substituindo a as respectivas equações mais a equação na equação ficamos com
onde:
- é o calor absorvido ou cedido por uma amostra de mols de um gás;
- é a variação de temperatura resultante;
- é a variação de energia interna.
Regra de Dulong-Petit[editar | editar código-fonte]
A regra de Dulong-Petit consiste em obter, aproximadamente, o calor específico das substâncias por meio da massa molar:
Em que:
- é o calor específico, em joule por quilograma kelvin (J.kg−1.K−1);
- é a constante dos gases reais, equivalente a 8,31 joules por mol kelvin (J.K−1.mol−1);
- é a massa molar, em quilograma por mol (kg/mol).
Determinação experimental do calor específico de uma substância[editar | editar código-fonte]
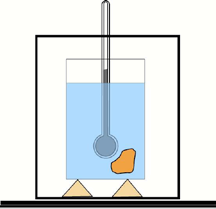
A capacidade calorífica de um corpo é determinada com ajuda de um calorímetro e um termômetro. Um calorímetro simples (veja a figura) consiste num cilindro metálico polido, colocado num outro cilindro metálico sobre cortiça (para isolamento térmico).[5]
O cilindro interno é enchido com água ou algum outro líquido de calor específico conhecido. Um corpo de massa m, e capacidade calorífica específica c, aquecido a uma certa temperatura T é imergido no calorímetro de massa m1 e capacidade calorífica c1 na qual a temperatura é medida. Suponha que a temperatura deste líquido de m2 e capacidade calorífica específica c2 no calorímetro é T’ antes de o corpo ser emergido nele, e quando a temperatura do líquido e do corpo é a mesma, a temperatura torna-se Tf.
Da lei de conservação da energia e considerando o calor dissipado na vizinhança pelo objecto quente Q, o calor recebido pela água e pelo calorímetro que seja respectivamente Q1 e Q2 , mostra que a capacidade calorífica específica é
Fatores que afetam o calor específico[editar | editar código-fonte]
Moléculas sofrem muitas vibrações características internas. A energia potencial armazenada nestes graus de liberdade internos contribui para uma amostra do conteúdo de energia, mas não a sua temperatura. Graus de liberdade mais internos tendem a aumentar a capacidade de uma substância de calor específico, contanto que as temperaturas são suficientemente elevadas para superar os efeitos quânticos.
Graus de liberdade[editar | editar código-fonte]
O comportamento termodinâmico das moléculas dos gases monoatômicos, como hélio, e dos gases diatômicos, como o nitrogênio, é muito diferente. Em gases monoatômicos, a energia interna é unicamente para movimentos de translação. Os movimentos são movimentos de translação em um espaço tridimensional em que as partículas se movem e trocam energia em colisões elásticas da mesma forma como fariam bolas de borracha colocadas num recipiente que foi agitado fortemente. (Veja animação aqui). Estes movimentos nas dimensões X, Y, e Z significam que os gases monoatômicos tem apenas três graus de liberdade de translação. Moléculas com maior atomicidade, no entanto, tem vários graus de liberdade interna, rotacionais e vibracionais. Elas se comportam como uma população de átomos que podem se mover dentro de uma molécula de formas diferentes (veja a animação à direita). A energia interna é armazenada nesses movimentos internos. Por exemplo, o nitrogênio, que é uma molécula diatômica, tem cinco graus de liberdade: três de translação e dois de rotação interna. Note que a calor específico molar a volume constante do gás monoatômico é , sendo R a constante universal do gás ideal, ao passo que para o valor do nitrogênio (diatômico) vale , o que mostra claramente a relação entre os graus de liberdade e ao calor específico.
onde é o número de graus de liberdade.
Massa molar[editar | editar código-fonte]
Uma razão pela qual o calor específico tem valores diferentes para diferentes substâncias é a diferença de massas molares, que é a massa de um mol de qualquer elemento, que é diretamente proporcional à massa molecular do elemento, a soma dos valores das massas atômicas da molécula em questão. A energia térmica é armazenada pela existência de átomos ou moléculas de vibração. Se uma substância tem uma massa molar mais leve, em seguida, cada grama de que tem mais átomos ou moléculas disponíveis para armazenar energia. Esta é a razão pela qual o hidrogênio, a substância com menor massa molar tem um calor específico muito elevado. A consequência deste fenômeno é a de que, quando se mede o calor específico em termos molares a diferença entre substâncias torna-se menos acentuada e o calor específico de hidrogênio para de ser atípico. Da mesma forma, as substâncias moleculares (também absorvem calor em seus graus de liberdade internos) pode armazenar grandes quantidades de energia por mol se é moléculas grandes e complexas, e, portanto, seu calor específico medido em massa é menos perceptível . Uma vez que a densidade média de um elemento químico está fortemente relacionada com a sua massa molar, em termos gerais, há uma forte correlação inversa entre a densidade do sólido e o (calor específico a pressão constante). Lingotes sólidos grandes de baixa densidade tendem a absorver mais calor do que um lingote pequeno de mesma massa, porém com densidade mais elevada que o primeiro, porque contém mais átomos. Por conseguinte, em termos gerais, há uma forte correlação entre o volume de um elemento sólido e a sua capacidade total de calor. No entanto, existem muitos desvios desta correlação.
As ligações de hidrogênio[editar | editar código-fonte]
Contendo hidrogênio na sua composição, moléculas polares como o etanol, amônia e água, têm poderosas ligações intermoleculares de hidrogênio quando em sua fase líquida. Estas ligações proporcionam um outro local em que o calor pode ser armazenado como energia potencial de vibração, mesmo em baixas temperaturas comparativamente.
Impurezas[editar | editar código-fonte]
No caso de ligas, existem certas condições em que as pequenas impurezas podem alterar grandemente o calor específico medido. As ligas podem mostrar uma diferença marcada no seu comportamento, mesmo que a impureza em questão seja um dos elementos que formam a liga, tais como ligas impuras em semicondutores ferromagnéticos que podem conduzir a medições muito diferentes.
A tabela abaixo apresenta o calor específico de algumas substâncias à pressão constante de 1 atm.
| Substância | Calor Específico (cal/g.°C) |
|---|---|
| água | 1,0 |
| álcool | 0,58 |
| alumínio | 0,22 |
| ar | 0,24 |
| carbono | 0,12 |
| chumbo | 0,031 |
| cobre | 0,094 |
| ferro | 0,11 |
| gelo | 0,5 |
| hélio | 1,25 |
| hidrogênio | 3,4 |
| latão | 0,092 |
| madeira | 0,42 |
| mercúrio | 0,033 |
| nitrogênio | 0,25 |
| ouro | 0,032 |
| oxigênio | 0,22 |
| prata | 0,056 |
| rochas | 0,21 |
| vidro | 0,16 |
| zinco | 0,093 |
teoria da relatividade categorial Graceli
ENERGIA, MASSA, FENÔMENOS, ESPAÇO, TEMPO, INTERAÇÕES, TRANSFORMAÇÕES, CONDUTIVIDADE, EMISSÕES, ABSORÇÕES, DIFRAÇÃO, MOMENTUM.
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
NO SISTEMA CATEGORIAL DE GRACELI TODO TIPO DE MOVIMENTO TEM AÇÃO TRANSFORMADORA [como os outros elementos, como temperatura, radioatividade, luz, e outros],SOBRE ESTRUTURAS E ENERGIAS, TEMPO E ESPAÇO, INÉRCIA E GRAVIDADE, LUZ .
Estados de Graceli de matéria, energias, momentuns, inércias, e entropias.
Estados térmico.
Estado quântico.
De dilatação.
De entropia.
De potencia de entropia e relação com dilatação.
De magnetismo [correntes, momentum e condutividades]..
De eletricidade [correntes, momentum e condutividades].
De condutividade.
De mometum e fluxos variados.
De potencial inercial da matéria e energia.
De transformação.
De comportamento de cargas e interações com elétrons.
De emaranhamentos e transemaranhamentos.
De paridades e transparidades.
De radiação.
Radioatividade.
De radioisótopos.
De relação entre radioatividade, radiação, eletromagnetismo e termoentropia.
De capacidade e potencialidade de resistir a pressão, a capacidade de resistir a pressão e transformar em entropia e momentum.
De resistir à temperaturas.
E transformar em dilatação, interações entre partículas, energias e campos.
Estado dos padrões de variações e efeitos variacionais.
Estado de incerteza dos fenômenos e entre as suas interações.
E outros estados de matéria, energia, momentum, tipos de inércia [como de inércia potencial de energias magnética, elétrica, forte e fraca, dinâmica, geométrica [côncava, convexa e plana] em sistema.
E que todos estes tipos de estados tendem a ter ações de uns sobre os outros, formando um aglomerado de fenômenos de efeitos na produção de novas causas. E de efeitos variacionais de uns sobre os outros, ou seja, um sistema integrado.
Sobre padrões de entropia.
Mesmo havendo uma desordem, esta desordem segue alguns parâmetros futuros e que dependem de condições dos estados de Graceli, ou seja, a desordem segue alguns padrões e ordens conforme avança e passa por fases e agentes fenomênicos, estruturais e geométricos.
Porem, a reversibilidade se torna impossível, aumenta a instabilidade e as incertezas de posição, intensidade, variações, efeitos e outros fenômenos conforme as próprias intensidades de dilatações, e agentes e estados envolvidos.
Levando em consideração que mesmo havendo ordem não é possível a reversibilidade do estado e condições em que se encontravam a energia, matéria, momentum, inércias, dimensões, e outros agentes.
A temperatura pode voltar ao seu lugar e ao seu ponto inicial, mas não as estruturas das partículas, as intensidades infinitésimas de padrões de energias, e nem o grau de oscilações que a energias, as interações, as transformações que passam estas partículas e suas energias, estruturas e interações, e as interações e intensidades de grau de variação de cada agente.
Porem, a desordem é temporal, ou seja, com o passar do tempo outras ordens e padrões se afirmarão.
Sendo que também a entropia varia conforme intensidade de instabilidade por tempo. E tempo por intensidade de instabilidade.
Assim, segue efeitos variacionais e de incertezas por instabilidade de energia adicionada, e de tempo.
Ou seja, uma grande instabilidade e desordem em pouco tempo vai levar a uma grande e instável por mais tempo uma entropia.
Do que um grande tempo com pequena intensidade de instabilidade e energia adicionada num sistema ou numa variação térmica.
Ou mesmo numa variação eletromagnética, ou mesmo na condutividade.
Princípio tempo instabilidade de Graceli.
Assim, a desordem acaba por encontrar uma ordem se não acontecer nenhuma instabilidade novamente. Pois, as partículas e energias tendem a se reorganizar novamente conforme o passar do tempo, e esta reorganização segue um efeito progressivo em relação à desordem e tempo. Como os vistos acima.
Ou seja, aquela organização anterior não vai mais acontecer, pois, segue o princípio da irreversibilidade, mas outras organizações se formarão conforme avança o tempo de estabilidade.
Estados térmico.
Estado quântico.
De dilatação.
De entropia.
De potencia de entropia e relação com dilatação.
De magnetismo [correntes, momentum e condutividades]..
De eletricidade [correntes, momentum e condutividades].
De condutividade.
De mometum e fluxos variados.
De potencial inercial da matéria e energia.
De transformação.
De comportamento de cargas e interações com elétrons.
De emaranhamentos e transemaranhamentos.
De paridades e transparidades.
De radiação.
Radioatividade.
De radioisótopos.
De relação entre radioatividade, radiação, eletromagnetismo e termoentropia.
De capacidade e potencialidade de resistir a pressão, a capacidade de resistir a pressão e transformar em entropia e momentum.
De resistir à temperaturas.
E transformar em dilatação, interações entre partículas, energias e campos.
Estado dos padrões de variações e efeitos variacionais.
Estado de incerteza dos fenômenos e entre as suas interações.
E outros estados de matéria, energia, momentum, tipos de inércia [como de inércia potencial de energias magnética, elétrica, forte e fraca, dinâmica, geométrica [côncava, convexa e plana] em sistema.
E que todos estes tipos de estados tendem a ter ações de uns sobre os outros, formando um aglomerado de fenômenos de efeitos na produção de novas causas. E de efeitos variacionais de uns sobre os outros, ou seja, um sistema integrado.
Sobre padrões de entropia.
Mesmo havendo uma desordem, esta desordem segue alguns parâmetros futuros e que dependem de condições dos estados de Graceli, ou seja, a desordem segue alguns padrões e ordens conforme avança e passa por fases e agentes fenomênicos, estruturais e geométricos.
Porem, a reversibilidade se torna impossível, aumenta a instabilidade e as incertezas de posição, intensidade, variações, efeitos e outros fenômenos conforme as próprias intensidades de dilatações, e agentes e estados envolvidos.
Levando em consideração que mesmo havendo ordem não é possível a reversibilidade do estado e condições em que se encontravam a energia, matéria, momentum, inércias, dimensões, e outros agentes.
A temperatura pode voltar ao seu lugar e ao seu ponto inicial, mas não as estruturas das partículas, as intensidades infinitésimas de padrões de energias, e nem o grau de oscilações que a energias, as interações, as transformações que passam estas partículas e suas energias, estruturas e interações, e as interações e intensidades de grau de variação de cada agente.
Porem, a desordem é temporal, ou seja, com o passar do tempo outras ordens e padrões se afirmarão.
Sendo que também a entropia varia conforme intensidade de instabilidade por tempo. E tempo por intensidade de instabilidade.
Assim, segue efeitos variacionais e de incertezas por instabilidade de energia adicionada, e de tempo.
Ou seja, uma grande instabilidade e desordem em pouco tempo vai levar a uma grande e instável por mais tempo uma entropia.
Do que um grande tempo com pequena intensidade de instabilidade e energia adicionada num sistema ou numa variação térmica.
Ou mesmo numa variação eletromagnética, ou mesmo na condutividade.
Princípio tempo instabilidade de Graceli.
Assim, a desordem acaba por encontrar uma ordem se não acontecer nenhuma instabilidade novamente. Pois, as partículas e energias tendem a se reorganizar novamente conforme o passar do tempo, e esta reorganização segue um efeito progressivo em relação à desordem e tempo. Como os vistos acima.
Ou seja, aquela organização anterior não vai mais acontecer, pois, segue o princípio da irreversibilidade, mas outras organizações se formarão conforme avança o tempo de estabilidade.
as dimensões categorias podem ser divididas em cinco formas diversificadas.
tipos, níveis, potenciais, tempo de ação, especificidades de transições de energias, de fenômenos, de estados de energias, físicos [estruturais], de fenômenos, estados quântico, e outros.
= entropia reversível
matriz categorial Graceli.
tipos, níveis, potenciais, tempo de ação, especificidades de transições de energias, de fenômenos, de estados de energias, físicos [estruturais], de fenômenos, estados quântico, e outros.
paradox of the system of ten dimensions and categories of Graceli.
a four-dimensional system can not define all the energies, changes of structures, states and phenomena within a structure, that is why there are ten or more dimensions, I have developed and I work with ten, but nature certainly goes beyond ten, with this we move to a decadimensional and categorial universe.
that is, categories ground the variables of phenomena and their interactions and transformations.
and with this we do not have a relationship with mass, but with structure, therefore, a structure carries with it much more than mass, since also mass is related to forces, inertia, resistances and energies.
but structures are related to transitions of physical states, quantum, energies, phenomena, and others.
as well as transitions of energies, phenomena, categories and dimensions.
paradoxo do sistema de dez dimensões e categorias de Graceli.
um sistema de quatro dimensões não tem como definir todas as energias, mudanças de estruturas, estados e fenômenos dentro de uma estrutura, por isto se tem dez ou mais dimensões, desenvolvi e trabalho com dez, mas a natureza com certeza vai alem das dez, com isto caminhamos para um universo decadimensional e categorial.
ou seja, as categorias fundamentam as variáveis dos fenõmenos e suas interações e transformações.
e com isto não se tem uma relação com massa, mas com estrutura, pois, uma estrutura carrega consigo muito mais do que massa, uma vez também que massa está relacionado com forças, inércia, resistências e energias.
mas estruturas está relacionado com transições de estados físicos, quântico, de energias, de fenômenos, e outros.
como também transições de energias, fenômenos, categorias e dimensões.
a four-dimensional system can not define all the energies, changes of structures, states and phenomena within a structure, that is why there are ten or more dimensions, I have developed and I work with ten, but nature certainly goes beyond ten, with this we move to a decadimensional and categorial universe.
that is, categories ground the variables of phenomena and their interactions and transformations.
and with this we do not have a relationship with mass, but with structure, therefore, a structure carries with it much more than mass, since also mass is related to forces, inertia, resistances and energies.
but structures are related to transitions of physical states, quantum, energies, phenomena, and others.
as well as transitions of energies, phenomena, categories and dimensions.
paradoxo do sistema de dez dimensões e categorias de Graceli.
um sistema de quatro dimensões não tem como definir todas as energias, mudanças de estruturas, estados e fenômenos dentro de uma estrutura, por isto se tem dez ou mais dimensões, desenvolvi e trabalho com dez, mas a natureza com certeza vai alem das dez, com isto caminhamos para um universo decadimensional e categorial.
ou seja, as categorias fundamentam as variáveis dos fenõmenos e suas interações e transformações.
e com isto não se tem uma relação com massa, mas com estrutura, pois, uma estrutura carrega consigo muito mais do que massa, uma vez também que massa está relacionado com forças, inércia, resistências e energias.
mas estruturas está relacionado com transições de estados físicos, quântico, de energias, de fenômenos, e outros.
como também transições de energias, fenômenos, categorias e dimensões.
= entropia reversível
postulado categorial e decadimensional Graceli.
TUDO QUE ESTÁ RELACIONADO COM ENERGIA, ESTRUTURAS, FENÔMENOS E DIMENSÕES ESTÁ INSERIDO NO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.
todo sistema decadimensional e categorial é um sistema transcendente e indeterminado.
TUDO QUE ESTÁ RELACIONADO COM ENERGIA, ESTRUTURAS, FENÔMENOS E DIMENSÕES ESTÁ INSERIDO NO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.
todo sistema decadimensional e categorial é um sistema transcendente e indeterminado.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
1] Cosmic space.
2] Cosmic and quantum time.
3] Structures.
4] Energy.
5] Phenomena.
6] Potential.
7] Phase transitions of physical [amorphous and crystalline] states and states of energies and phenomena of Graceli.
8] Types and levels of magnetism [in paramagnetic, diamagnetic, ferromagnetic] and electricity, radioactivity [fissions and fusions], and light [laser, maser, incandescence, fluorescence, phosphorescence, and others.
9] thermal specificity, other energies, and structure phenomena, and phase transitions.
10] action time specificity in physical and quantum processes.
2] Cosmic and quantum time.
3] Structures.
4] Energy.
5] Phenomena.
6] Potential.
7] Phase transitions of physical [amorphous and crystalline] states and states of energies and phenomena of Graceli.
8] Types and levels of magnetism [in paramagnetic, diamagnetic, ferromagnetic] and electricity, radioactivity [fissions and fusions], and light [laser, maser, incandescence, fluorescence, phosphorescence, and others.
9] thermal specificity, other energies, and structure phenomena, and phase transitions.
10] action time specificity in physical and quantum processes.
Sistema decadimensional Graceli.
1]Espaço cósmico.
2]Tempo cósmico e quântico.
3]Estruturas.
4]Energias.
5]Fenômenos.
6]Potenciais., e potenciais de campos, de energias, de transições de estruturas e estados físicos, quãntico, e estados de fenômenos e estados de transições, transformações e decaimentos.
7]Transições de fases de estados físicos [amorfos e cristalinos] e estados de energias e fenômenos de Graceli.
8]Tipos e níveis de magnetismo [em paramagnéticos, diamagnético, ferromagnéticos] e eletricidade, radioatividade [fissões e fusões], e luz [laser, maser, incandescências, fluorescências, fosforescências, e outros.
9] especificidade térmica, de outras energias, e fenômenos das estruturas, e transições de fases.
10] especificidade de tempo de ações em processos físicos e quântico.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Matriz categorial de Graceli.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
Tipos, níveis, potenciais, tempo de ação, temperatura, eletricidade, magnetismo, radioatividade, luminescências, dinâmicas, estruturas, fenômenos, transições de fenômenos e estados físicos, e estados de energias, dimensões fenomênicas de Graceli.
[estruturas: isótopos, partículas, amorfos e cristalinos, paramagnéticos, dia, ferromagnéticos, e estados [físicos, quântico, de energias, de fenômenos, de transições, de interações, transformações e decaimentos, emissões e absorções, eletrostático, condutividade e fluidez]].
trans-intermecânica de supercondutividade no sistema categorial de Graceli.
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].


















































































 = entropia reversível
= entropia reversível